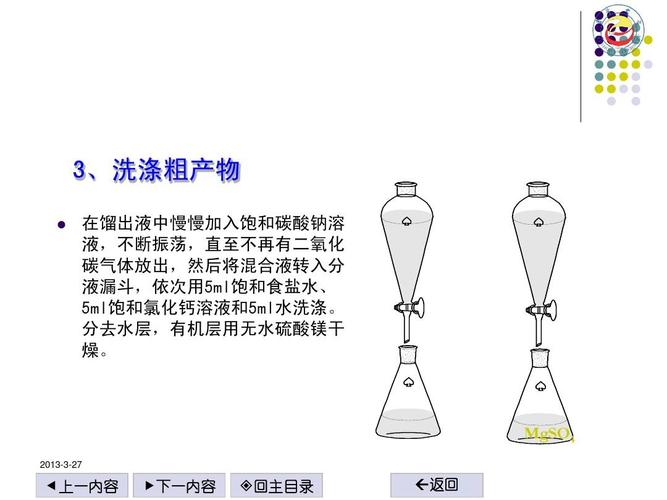
萃取時為何要加飽和食鹽水?深入解析鹽析、相分離與破乳化的關鍵作用
在化學實驗室或工業生產中,萃取(Extraction)是一種廣泛應用於分離與純化目標物質的重要技術。它通常涉及兩種互不相溶的液體,例如水相與有機相,利用目標物質在不同溶劑中溶解度的差異來進行分離。然而,在許多萃取過程中,您可能會觀察到一個常見的步驟:向混合物中加入飽和食鹽水。這一步驟看似簡單,卻在實際操作中扮演著至關重要的角色。本文將深入探討,為何在萃取時需要加入飽和食鹽水,並詳細解析其背後的科學原理與多重效益。
Table of Contents
萃取製程中的重要推手:飽和食鹽水
飽和食鹽水(Saturated Brine),顧名思義,是指氯化鈉(NaCl)溶解在水中達到其最大溶解度極限的溶液。由於其高離子濃度與獨特的物理化學性質,使其在液-液萃取過程中發揮著不可替代的作用。其主要功能可歸納為以下幾點:
鹽析效應(Salting Out Effect):提升目標物萃取效率的關鍵
這是向萃取體系中加入飽和食鹽水最主要的原因之一。鹽析效應是指在水溶液中加入大量電解質(如食鹽)後,會導致某些有機物質(特別是極性較低或中等極性的有機化合物)在水中的溶解度顯著降低的現象。
作用原理:
- 競爭水分子: 食鹽(NaCl)在水中會解離成大量的鈉離子(Na⁺)和氯離子(Cl⁻)。這些離子具有很強的親水性,會與水分子形成強烈的氫鍵或離子-偶極相互作用,從而佔據水分子,使其「脫離」去溶解有機溶質。
- 減少有機溶質的溶解空間: 隨著大量離子的存在,水分子用於溶解有機溶質的「自由空間」或可用性大大減少。這就好比一個擁擠的派對,當涌入更多的客人(鹽離子)時,原來的客人(有機分子)就不得不被擠出去了。
- 改變水相的極性: 高濃度的離子會使水相的有效極性(effective polarity)增加,對於極性較低的有機分子而言,水相的環境變得更不「友善」,從而加速其從水相中分離出來,進入極性更相近的有機相中。
效益: 透過鹽析效應,原本在水相中有一定溶解度的目標有機化合物會被「趕出」水相,被迫轉移到有機溶劑中,從而大大提高萃取效率和產率。
促進相分離:讓兩相分層更清晰迅速
液-液萃取成功的基礎是兩種不互溶的液體能夠清晰地分層。飽和食鹽水在這方面也發揮著重要作用。
作用原理:
- 增加水相密度: 食鹽的密度(約2.16 g/cm³)遠大於水(1.0 g/cm³)。將大量食鹽溶解在水中形成飽和溶液後,水相的密度會顯著增加(約1.2 g/mL)。
- 增大兩相密度差: 當水相密度增加後,它與有機相(通常密度小於1.0 g/mL,例如乙醚約0.71 g/mL,乙酸乙酯約0.90 g/mL)之間的密度差會變得更大。
效益: 密度差的增大使得兩相在靜置後能更快、更徹底地分離。這對於使用分液漏斗操作的實驗尤其重要,能夠縮短等待時間,並減少操作上的誤差,確保能夠清晰地識別並分離水相與有機相,避免混淆和交叉污染。
破乳化作用(Emulsion Breaking):有效解決惱人的乳化現象
在萃取過程中,特別是當兩種液體被劇烈搖晃或攪拌時,有時會形成難以分層的乳化層(Emulsion)。乳化是一種兩種不互溶的液體以微小液滴形式均勻分散在另一種液體中的穩定混合物,類似於牛奶。乳化層的形成會嚴重阻礙萃取的進行,因為它會使目標物質被困在其中,難以分離。
作用原理:
- 降低表面張力: 某些有機雜質或目標物質本身可能具有表面活性,充當乳化劑,降低兩相之間的界面張力,從而穩定乳液。飽和食鹽水中的高濃度離子可以有效競爭這些表面活性物質,或直接改變水相的極性環境,使其表面活性降低,進而破壞乳液的穩定性。
- 「搶奪」水分子: 鹽析效應的原理再次發揮作用。高濃度的鹽離子會與水分子強烈結合,降低水分子對乳化劑的溶解能力,使其從水相中析出,失去穩定乳液的作用。
- 促進小液滴聚結: 離子的存在改變了液滴周圍的電場,有助於帶有相同電荷的小液滴克服排斥力,彼此聚結成更大的液滴,最終分層。
效益: 加入飽和食鹽水可以有效地破壞或防止乳化層的形成。一旦乳化層被破壞,原本混濁的界面會變得清晰,液體分層明顯,大大簡化後續的分離操作,減少目標物質的損失。
減少有機溶劑在水相中的溶解度:減少損耗
雖然有機溶劑和水通常被認為是不互溶的,但實際上,大多數有機溶劑在水中仍然存在微量的溶解度。尤其是一些極性稍高的有機溶劑,如乙醚、乙酸乙酯等,其在水中的溶解度相對較高。
作用原理: 類似於鹽析效應對目標有機物的影響,飽和食鹽水中的高濃度離子也會「排擠」有機溶劑分子,使其在水相中的溶解度進一步降低。
效益: 這有助於最大限度地減少有機溶劑在水相中的損失。在大規模生產或使用昂貴有機溶劑的實驗中,這可以帶來顯著的成本節省。同時,也使水相廢液中的有機溶劑含量降低,有助於環保處理。
其他考量與應用技巧
使用飽和食鹽水的注意事項
- 溶液準備: 應確保食鹽水真正達到飽和狀態,即底部有未溶解的食鹽顆粒。這保證了最高的離子濃度,以實現最佳的鹽析和破乳效果。
- 添加方式: 加入飽和食鹽水時,建議緩慢加入並輕輕旋動或搖晃混合物,而非劇烈搖晃,以避免再次引入空氣或過度攪拌導致新的乳化問題。
- pH值影響: 純淨的飽和食鹽水溶液通常是中性的。因此,它通常不會顯著改變萃取體系的pH值。然而,若萃取目標物質的穩定性或溶解度對pH值敏感,則需額外考慮並調節pH。
- 適用性: 雖然飽和食鹽水應用廣泛,但並非所有萃取都適用。對於那些在飽和食鹽水中溶解度反而會增加的物質(例如某些高度親水的離子化合物),則不宜使用。
結論
綜上所述,在萃取過程中加入飽和食鹽水,絕非一個可有可無的步驟。它透過鹽析效應顯著提高目標有機物的萃取效率;透過增大密度差促進水相與有機相的快速清晰分離;並透過破乳化作用有效解決令人頭痛的乳化問題;同時也減少了有機溶劑在水相中的損耗。這些多重效益共同確保了萃取過程的順利進行、高效完成,並最終提升了目標產物的純度和產量。因此,掌握「萃取時為何要加飽和食鹽水」的原理,是每一位化學工作者進行液-液萃取操作時的必備知識。
常見問題(FAQ)
為何在萃取後,水相仍然需要用飽和食鹽水清洗?
這通常是為了進行「鹽水洗」(brine wash)步驟。其目的是進一步去除有機相中可能殘留的微量水滴、水溶性雜質,以及防止或破壞在分離過程中可能形成的細微乳化層。透過再次利用鹽析原理,將有機相中殘存的水分子「拉出」,使有機相更加乾燥和純淨。
如何判斷食鹽水是否已達到「飽和」狀態?
判斷食鹽水是否飽和最直觀的方法是觀察溶液底部是否有未溶解的食鹽顆粒。如果在攪拌後仍有固體食鹽存在,並且不再溶解,則表示該食鹽水已達到飽和狀態。
為何有些萃取實驗不需添加飽和食鹽水?
並非所有萃取都需要飽和食鹽水。如果目標有機物本身在水中的溶解度極低,或者水相與有機相的密度差異已足夠大、不易形成乳化層,那麼添加飽和食鹽水可能就不是必需的。此外,如果目標物質在高鹽濃度下穩定性差或溶解度反而降低,也不應添加。
添加飽和食鹽水會對萃取產物的純度造成影響嗎?
通常情況下,添加飽和食鹽水對萃取產物的純度有正面影響。它主要幫助將目標有機物從水相中驅逐出來,同時將水溶性雜質留在水相中,減少這些雜質隨同目標物進入有機相的可能性。除非目標物本身也是鹽類,或者極性非常高,否則一般不會造成負面影響。