酸鹼指示劑變色範圍:解鎖化學奧秘與實務應用指南
欸,你是不是也跟我一樣,曾經在化學課上,看到老師滴了幾滴透明的液體,燒杯裡的溶液就突然「唰」的一下變了顏色,心裡不禁驚嘆:「哇塞,這是什麼魔法啊?」然後又有點搞不懂,為什麼有些時候用這種指示劑,有些時候卻要換另一種?這背後其實一點也不玄妙,關鍵就在於「酸鹼指示劑變色範圍」這個超重要的概念!簡單來說,酸鹼指示劑是一種特殊的化學物質,它會根據所處溶液的酸鹼度(pH值)不同,而呈現出不一樣的顏色。而它的「變色範圍」,就是指它從一種顏色完全轉變成另一種顏色所需的pH值區間。理解這個範圍,對於我們在實驗室裡做精確滴定、甚至在日常生活中判斷某些物質的酸鹼性,都是至關重要的!
Table of Contents
深入剖析:酸鹼指示劑變色範圍的科學奧秘
要真正理解酸鹼指示劑的奧秘,我們得稍微深入一點化學的底層邏輯。這可不是光看表面顏色那麼簡單喔!
什麼是酸鹼指示劑?
酸鹼指示劑(pH indicator)本質上是一種弱酸或弱鹼,它們的「分子形式」和「離子形式」有著不同的顏色。比如說,一種指示劑如果以HIn(酸式)存在時是紅色,而以In-(鹼式)存在時是藍色,那麼當溶液的pH值改變,導致HIn和In-的比例發生變化時,我們就能觀察到顏色轉換。
「變色範圍」的化學機制:為何會變色?
指示劑之所以能變色,是因為它們在溶液中存在著一種可逆的化學平衡,通常可以表示為:
HIn (酸式,一種顏色) ⇌ H+ + In– (鹼式,另一種顏色)
根據勒沙特列原理(Le Chatelier’s Principle),當溶液變酸(H+濃度增加)時,平衡會向左移動,生成更多的HIn,我們就會看到酸式的顏色;反之,當溶液變鹼(H+濃度減少,或OH–濃度增加消耗H+)時,平衡會向右移動,生成更多的In–,我們就會看到鹼式的顏色。
而這個「變色範圍」呢,其實就是指示劑的酸式與鹼式形態共存的pH區間。通常來說,當酸式形態(HIn)的濃度是鹼式形態(In–)的10倍以上時,我們只能看到酸式的顏色;當鹼式形態(In–)的濃度是酸式形態(HIn)的10倍以上時,我們則只能看到鹼式的顏色。介於這兩種極端情況之間的pH值範圍,就是我們肉眼可以觀察到顏色從一種逐漸過渡到另一種的區間,也就是它的「變色範圍」。這個範圍通常大約落在指示劑的pKa值(解離常數的負對數)±1的區間內。
pH值的奧秘:它代表什麼?
pH值是衡量溶液酸鹼性強弱的指標,它的定義是溶液中氫離子(H+)濃度負對數的相反數(pH = -log[H+])。pH值越小表示酸性越強,pH值越大表示鹼性越強。清水在室溫下的pH值約為7,呈現中性。
選對指示劑,實驗成功一半:實用指南
在化學滴定中,選對酸鹼指示劑,真的就像打遊戲選對角色一樣,直接影響成敗!我個人經驗是,選錯了指示劑,就算你的滴定手法再好,結果也可能天差地遠。
如何選擇適合的酸鹼指示劑?
選擇指示劑的關鍵在於,它的變色範圍必須涵蓋或非常接近你所進行滴定的「等當點」。等當點是指酸和鹼恰好完全反應的點,理論上來說,此時溶液的pH值會發生一個急劇的跳變。而指示劑的任務,就是在這個跳變點附近精準地變色,告訴我們反應達到了終點。
- 強酸滴定強鹼(或反之): 等當點通常在pH 7左右。此時,我們可以選擇變色範圍涵蓋pH 7的指示劑,例如溴百里酚藍(Bromothymol Blue)。
- 強酸滴定弱鹼: 等當點會落在pH 7以下(酸性範圍)。這時候,就需要選擇在酸性範圍變色的指示劑,像是甲基橙(Methyl Orange)。
- 弱酸滴定強鹼: 等當點會落在pH 7以上(鹼性範圍)。酚酞(Phenolphthalein)就是個很好的選擇,它的變色範圍在鹼性。
記住一點:滴定終點(指示劑變色的點)和等當點(理論上酸鹼恰好反應完的點)越接近,你的實驗結果就越準確。
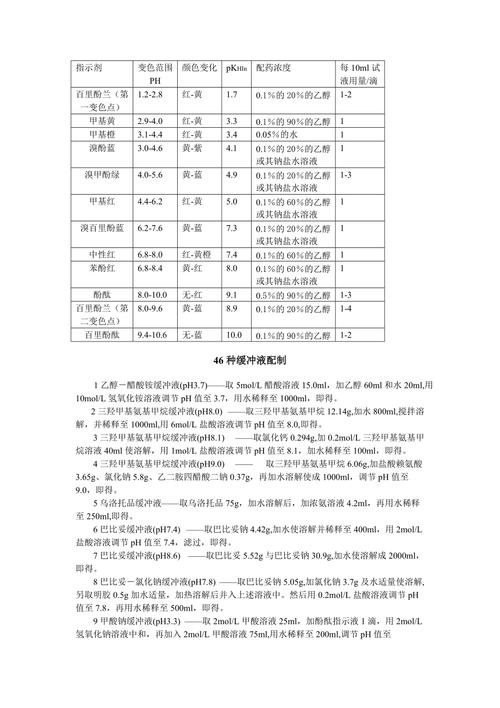
常見酸鹼指示劑及其變色範圍一覽
為了方便大家參考,我整理了一個常用酸鹼指示劑的表格。你會發現,每種指示劑都有它獨特的「個性」和「專長」喔!
| 指示劑名稱 | 變色範圍 (pH) | 酸性顏色 | 鹼性顏色 | 適用場景舉例 |
|---|---|---|---|---|
| 甲基橙 (Methyl Orange) | 3.1 – 4.4 | 紅 | 黃 | 強酸滴定弱鹼 |
| 甲基紅 (Methyl Red) | 4.4 – 6.2 | 紅 | 黃 | 微生物培養、某些生物化學實驗 |
| 溴百里酚藍 (Bromothymol Blue) | 6.0 – 7.6 | 黃 | 藍 | 強酸滴定強鹼、水族箱pH監測 |
| 酚酞 (Phenolphthalein) | 8.2 – 10.0 | 無色 | 紅/紫紅 | 弱酸滴定強鹼 |
| 百里酚藍 (Thymol Blue) | 1.2 – 2.8 (酸性範圍) 8.0 – 9.6 (鹼性範圍) |
紅 黃 |
黃 藍 |
兩種變色範圍,可應用於不同pH值區間 |
這張表是不是讓你看起來更清楚了?不同的指示劑就像是為不同的pH值區間量身打造的偵測器,各司其職呢。
滴定中的關鍵角色:指示劑的應用
滴定(Titration)是化學實驗室裡一個非常基本且重要的分析方法,用來測定未知濃度溶液的精確濃度。而酸鹼指示劑在其中扮演的角色,就是那個「報警器」!
想像一下這個情境:你正在用已知濃度的鹽酸(酸)去滴定未知濃度的氫氧化鈉(鹼)。當你緩緩地將鹽酸滴入氫氧化鈉溶液中,溶液的pH值會逐漸變化。一開始,溶液是強鹼性的。隨著酸的加入,鹼性慢慢降低。當接近等當點時,pH值會發生一個非常快速的「陡峭跳變」。這個跳變範圍就是指示劑發揮作用的時機!
以酚酞為例,它在pH值小於8.2時是無色的,但在pH值大於10.0時則呈現紅紫色。如果我們用它來滴定強鹼,一開始燒杯裡的溶液會是紅紫色。當你不斷加入酸,溶液pH值逐漸下降,一旦pH值落入8.2到10.0的變色範圍內,溶液的顏色就會從紅紫色漸漸變淺,直到變成無色。當它剛剛變成無色且能維持30秒不變回紅色時,我們就認定達到了滴定終點。這個時候,你就可以根據所消耗的酸的體積,計算出未知鹼的濃度囉!是不是很神奇?
不僅限於實驗室:酸鹼指示劑的日常與產業應用
你可能會覺得,酸鹼指示劑聽起來很高大上,好像只存在於化學實驗室裡。但其實,它們的應用範圍比你想像的還要廣泛,深入到我們的生活、農業、工業甚至醫療領域,無處不在!
環境監測與水質檢測
- 水族箱pH值: 養魚的朋友們一定知道,魚類對水質的pH值要求很高。太酸或太鹼的水都會讓魚兒生病。很多水族箱的測試套件裡,就包含了pH指示劑,透過顏色變化來快速判斷水質是否適合魚兒生存。
- 雨水酸化監測: 環境科學家會使用pH指示劑來監測雨水的酸鹼度,判斷是否有酸雨現象,這對於評估環境污染狀況非常重要。
- 廢水處理: 工業廢水在排放前通常需要調整其pH值達到中性,以避免對環境造成污染。指示劑在這裡也扮演著快速檢測和調節的角色。
農業與土壤pH值管理
「靠山吃山,靠土種土」,土壤的pH值直接影響著植物對養分的吸收效率。不同的作物對土壤pH值有不同的偏好,比如茶葉喜歡酸性土壤,而大多數蔬菜則喜歡微酸到中性的土壤。
- 土壤檢測: 農民和園藝愛好者可以使用簡易的土壤pH測試套件,裡面就含有pH指示劑。將土壤樣品與指示劑混合,根據顏色變化就能快速判斷土壤的酸鹼度,進而決定是否需要施加石灰(提高pH值)或硫磺(降低pH值)來調整土壤,確保作物健康生長,提升產量。
食品加工與品質控制
食品的pH值對其風味、質地、保鮮期和安全性都有著決定性的影響。你知道嗎?很多食品的生產過程中,也離不開酸鹼指示劑的幫助!
- 乳製品發酵: 優酪乳、起司等乳製品的製作過程中,發酵菌會產生乳酸,導致pH值下降。透過指示劑監控pH值,可以確保發酵過程達到最佳狀態,控制產品的酸度和風味。
- 果汁與飲料: 果汁的酸度會影響口感和保存。生產商會用指示劑來監測和調整果汁的pH值,使其符合標準。
- 肉類和魚類鮮度: 新鮮的肉類和魚類通常呈微酸性。隨著時間的推移,細菌分解會產生鹼性物質,導致pH值升高。有些指示劑可以幫助判斷肉類和魚類的新鮮程度,保障食品安全。
醫療與生物研究
在生物和醫學領域,pH值的精確控制和監測更是無比重要,因為生物體內的許多生化反應都對pH值非常敏感。
- 尿液檢測: 醫生會利用含有pH指示劑的試紙來檢測病人的尿液pH值,這有助於診斷泌尿系統感染、腎臟疾病或代謝性疾病。
- 細胞培養: 在細胞培養實驗中,培養基的pH值必須保持在一個非常狹窄的範圍內,才能確保細胞的正常生長。許多培養基中本身就含有酚紅等pH指示劑,透過顏色的變化可以直觀地監控培養基的酸鹼度。
- 酶反應研究: 許多酶在特定pH範圍內活性最高。研究人員會使用指示劑來優化酶反應的條件。
家庭生活中的小妙用
其實,我們的居家生活裡,也藏著酸鹼指示劑的蹤影喔!
- 肥皂水檢測: 某些家用pH測試紙,可以拿來檢測肥皂或清潔劑的酸鹼性,了解它們是否屬於中性、酸性或鹼性。
- 自製pH試紙: 你知道嗎,用紅包菜(紫甘藍)的汁液就可以自製天然的pH指示劑!將紫甘藍煮水後得到的紫色汁液,在酸性條件下會變紅,鹼性條件下會變藍綠色,超好玩的,可以和孩子一起動手做做看,觀察各種家用液體的顏色變化。
使用酸鹼指示劑的注意事項與常見誤區
雖然酸鹼指示劑看起來很方便,但在實際使用中,還是有一些「眉角」要注意的,不然可能會影響判斷的準確性喔!
濃度的影響
指示劑的濃度雖然通常很低,但如果加入太多,可能會改變被測溶液本身的pH值,特別是當被測溶液是稀溶液或緩衝能力較弱的時候。此外,濃度過高也可能導致顏色過深,難以判斷精確的變色點。
溫度效應
別小看溫度!大多數指示劑的變色範圍在不同溫度下會略有差異。這是因為指示劑的解離平衡常數(pKa值)會隨溫度而變化。因此,在進行精確的pH測量或滴定時,最好能在恆溫條件下進行,或者參考特定溫度下的指示劑數據。
背景顏色干擾
如果被測溶液本身就有顏色,那麼指示劑的顏色變化可能會被溶液本身的顏色「吃掉」或干擾,導致判斷困難。舉例來說,如果你想用酚酞滴定一杯藍色的溶液,酚酞的紅紫色變化可能會不明顯。這時候,可能就需要考慮使用pH計來進行更精確的測量。
緩衝溶液的影響
當你在緩衝溶液中使用指示劑時,你會發現顏色變化不像在純水或非緩衝溶液中那麼明顯。這是因為緩衝溶液有抵抗pH值變化的能力,即使加入少量酸或鹼,pH值也不會立即大幅度改變。這時候,指示劑的變色範圍可能顯得「不明顯」,需要更仔細的觀察。
我的經驗談:如何精準判讀指示劑顏色
作為一個常常跟化學試劑打交道的人,我個人覺得,判讀指示劑的顏色,特別是在滴定終點,真的是一門技術活,需要一點練習和「手感」。
我的秘訣有幾個:
- 充足的光線: 這是最基本卻也最容易被忽略的。確保你在一個光線充足且均勻的環境下觀察,最好是白色的背景,這樣能讓顏色對比更明顯。
- 對比標準: 如果可能的話,旁邊放一個空白對照組(只含溶劑和指示劑),或者一個剛過量的樣品,這樣可以更好地對比顏色變化。
- 「剛剛」變色: 判斷終點時,不是看它顏色變得多深,而是看它「剛剛」變色的那一瞬間。例如,酚酞從無色變到「淡粉色」的那一滴,通常就是終點。再多一滴,顏色可能就太深了,結果就不準了。許多資深實驗人員會說:「看到顏色出來但馬上消失,然後再多一滴,顏色出來又不消失,那就是終點。」這種感覺就是經驗累積來的。
- 搖晃均勻: 每次滴加指示劑或滴定液後,都要輕輕搖晃燒杯,確保溶液混合均勻,這樣指示劑才能充分反應,給出真實的顏色。
- 練習再練習: 真的沒別的,多做幾次,你自然就會對不同指示劑的顏色變化有更敏銳的觀察力了。熟能生巧嘛!
常見問題與專業解答
我知道很多人對於酸鹼指示劑還是會有些疑問,我在這裡整理了一些常見的問題,並提供我的專業解答,希望能幫助你更深入理解。
Q1: 酸鹼指示劑的變色範圍為什麼不是一個單一的pH值?
這是一個很棒的問題!很多初學者會以為指示劑在某個特定的pH值會「突然」變色。但實際上,就像前面提到的,指示劑是一個可逆的平衡體系:HIn ⇌ H+ + In–。它的顏色是取決於酸式(HIn)和鹼式(In–)兩種形態的相對濃度比例。當HIn和In–的濃度比例大約在10:1到1:10之間時,我們的肉眼才能觀察到顏色從一種主導色漸變到另一種主導色。這就是一個pH值的「範圍」,而不是一個「點」。想像一下,你把紅色和藍色顏料慢慢混合,會經歷紅、紅紫、紫、藍紫、藍的過渡,而不是突然從紅跳到藍。指示劑的變色也是類似的道理,這也是為什麼我們稱之為「變色範圍」,而不是「變色點」。
Q2: 甲基橙和酚酞在滴定中各適用於哪種情況?
這兩種指示劑是高中化學實驗室的常客了,它們各有各的「專長」:
- 甲基橙 (Methyl Orange): 它的變色範圍是pH 3.1 – 4.4,酸性顏色是紅色,鹼性顏色是黃色。它主要用於強酸滴定弱鹼的場合。在這種滴定中,等當點會落在酸性範圍(通常在pH 3-6之間)。由於甲基橙的變色範圍落在這個區間,它能精確地指示終點。例如,鹽酸(強酸)滴定氨水(弱鹼)時,就是甲基橙的舞台。如果你用酚酞去滴定,你可能會發現酚酞一直保持無色,或者顏色變化非常不明顯,因為它的變色範圍在鹼性,根本觸及不到等當點。
- 酚酞 (Phenolphthalein): 它的變色範圍是pH 8.2 – 10.0,酸性顏色是無色,鹼性顏色是紅紫色。它主要用於弱酸滴定強鹼的場合。這類滴定的等當點會落在鹼性範圍(通常在pH 8-11之間)。酚酞的變色點正好在等當點的陡峭跳變區間內。例如,醋酸(弱酸)滴定氫氧化鈉(強鹼)時,酚酞就是理想的選擇。反之,如果用甲基橙去滴定,你可能會看到它早早就變色了(還沒到等當點),或者根本沒有精確的變色點,導致實驗結果錯誤。
所以,選擇指示劑的關鍵,就是看你的等當點大概落在哪個pH區間,然後去找變色範圍能涵蓋那個區間的指示劑。
Q3: 如果指示劑的變色範圍不落在等當點附近會怎麼樣?
如果指示劑的變色範圍沒有涵蓋滴定的等當點,那麼你的實驗結果就會不準確,甚至完全錯誤。舉例來說:
- 指示劑提前變色: 如果你選用的指示劑在等當點之前就變色了(例如,強酸滴定強鹼,等當點在pH 7,但你用了甲基橙,它在pH 4.4就變黃了),那麼你會提前停止滴定。這會導致你誤以為所需的滴定液體積較少,從而計算出待測溶液的濃度比實際值低。這就像你跑馬拉松,還沒到終點線,計時器就提前響了,你肯定會得到一個錯誤的成績。
- 指示劑延後變色: 如果指示劑在等當點之後才變色(例如,弱酸滴定強鹼,等當點在pH 9左右,但你用了甲基紅,它在pH 6.2才變黃),那麼你會滴加過量的滴定液,等到它變色時,反應其實已經過量很久了。這會導致你計算出待測溶液的濃度比實際值高。這就像馬拉松計時器延後響了,你會多跑一段路,成績自然就超出了實際應有的時間。
因此,確保指示劑的變色範圍與滴定的等當點匹配,是進行精確酸鹼滴定的基本要求,也是判斷實驗成功的關鍵要素。
Q4: 除了變色指示劑,還有其他測量pH值的方法嗎?
當然有!變色指示劑雖然方便快捷,但它的精確度畢竟有限,而且容易受溶液顏色干擾。在需要更高精確度或自動化的場合,我們通常會使用以下方法:
- pH計 (pH Meter): 這是實驗室中最常用也最精確的pH測量儀器。pH計利用電位差原理,透過一個玻璃電極來感應溶液中氫離子的濃度,然後將電位差轉換為pH值顯示出來。它的優點是測量精確、讀數直接、不受溶液顏色影響,而且可以連續監測pH值變化。缺點是儀器成本較高,需要定期校正。在精密科學研究、工業生產質量控制等領域,pH計是不可或缺的工具。
- pH試紙 (pH Test Paper): pH試紙是在濾紙上浸漬了多種混合指示劑的產品。將試紙浸入溶液中,它會根據溶液的pH值顯示出不同的顏色,然後對照試紙盒上的標準色卡,就可以大概判斷溶液的pH值。pH試紙的優點是成本低、使用方便、攜帶便利。缺點是精確度較差,通常只能讀取到0.5到1個pH單位的精度,而且受溶液顏色影響較大。它適用於快速、粗略地判斷pH值,例如家庭園藝、水族箱初步檢測等。
選擇哪種測量方法,取決於你的應用場景對精確度的要求、溶液的特性以及可用的資源。
Q5: 指示劑可以重複使用嗎?
一般而言,添加到溶液中用來判斷終點的酸鹼指示劑,是不能「回收」或「重複使用」的。
這是因為:
- 已經反應: 一旦指示劑被加入到待測溶液中並發生變色,它就已經參與了化學平衡或與溶液中的酸/鹼發生了反應(即使只是很微量的指示劑)。你無法將它從複雜的溶液混合物中完整且純淨地分離出來。
- 濃度稀釋: 即使你能夠神奇地分離出來,它的濃度也已經被稀釋了,不再是標準的指示劑溶液。
- 污染風險: 嘗試回收指示劑會帶來嚴重的交叉污染風險,這會直接影響未來實驗的準確性。
所以,當你在實驗中用指示劑判斷出終點後,這份溶液通常就會被視為實驗廢液,按照實驗室規定進行處理。指示劑本身是作為耗材使用的,成本相對較低,因此不會考慮回收利用。但在某些特定情況下,例如:
- 自製指示劑: 像是前面提到的紫甘藍汁,如果你只是用它來做日常簡單的pH粗測,那倒是可以多做一些,放在冰箱裡保存幾天,可以重複取用來做不同的測試。但這並非嚴謹的化學實驗用途。
- 儲存的指示劑溶液: 指的是尚未添加到樣本中,保存在試劑瓶裡的指示劑「原液」。只要保存得當,避免污染和光照分解,這些儲存的指示劑溶液當然可以重複取用,直到用完為止。
總之,對於已經添加到實驗溶液中的指示劑,就讓它們「功成身退」吧!
結語
從實驗室的精確滴定,到日常生活的方方面面,酸鹼指示劑變色範圍這個概念,雖然聽起來有點學術,但它其實是解鎖化學奧秘、理解物質特性的關鍵鑰匙之一。它不僅僅是化學課本上的一個知識點,更是幫助我們深入了解世界、確保產品品質、維護環境健康的重要工具。
下次當你看到溶液變色時,不妨停下來想想,這背後是哪一種指示劑在發揮作用?它的變色範圍是什麼?這又代表了溶液怎樣的酸鹼度?透過這種好奇和探究,你就會發現,化學其實一點也不枯燥,它充滿了邏輯和美麗的變化,就等著我們去發現、去應用呢!